理化学研究所(理研)生命医科学研究センター 細胞機能変換技術研究チームの田中 優希 大学院生リサーチ・アソシエイト、鈴木 治和 チームリーダー、鈴木 貴紘 客員主管研究員らの研究チームは、ヒトiPS細胞[1]から肝細胞様細胞に分化する際のオミックス[2]データを公開しました。
本研究成果は、データサイエンス[3]による再生医療や創薬の研究に貢献すると期待できます。
肝細胞は肝臓の約70~85%を構成し、身体の健康を保つのに重要な役割を担うとともに、再生医療や創薬の観点からも重要とされています。また近年、科学の研究成果やデータを公開し、再利活用を推進するオープンサイエンス[4]のニーズが高まっています。しかし、公開データには品質の低いものも混在しているため、客観的に品質を評価されたデータの公開が重要です。
今回、研究チームは2022年に取得した、ヒトiPS細胞から肝細胞様細胞の分化誘導過程で得られた経時的網羅的なゲノム[2]・トランスクリプトーム[2]・エピゲノム[2]データを再解析し、これらのデータの品質と信頼性を評価しました。
本研究は、オンライン科学雑誌『Scientific Data』(2月14日付)に掲載されました。
背景
肝臓の約70~85%を構成する肝細胞は、アルコールや薬剤といった身体に有害な物質の解毒、アミノ酸からエネルギーを引き出す糖新生やその過程で生じるアンモニアの処理、血中コレステロ―ル値の制御に必要な胆汁の生成など、さまざまな機能を担っています。そのため、肝炎や肝硬変などにより肝細胞が欠乏すると、深刻な健康障害が生じます。現在、重篤な肝疾患の治療には生体肝移植が有効とされています。また、肝細胞は新薬開発過程で肝毒性試験にも用いられており、創薬という観点からも重要な細胞です。しかし、これらの基となる肝臓の慢性的なドナー不足から、肝細胞や肝臓を体外で作り出す技術の確立が強く求められています。
近年、多能性幹細胞[1]から肝細胞様細胞を誘導する方法が開発されました。ヒトiPS細胞からは、胚体内胚葉細胞[5]、肝芽細胞様細胞、肝細胞様細胞へと段階的に分化誘導されます。この誘導は転写因子[6]がもたらす遺伝子発現の連続的かつ正確な変化に加え、DNAメチル化[7]状態、クロマチン[8]状態の変化も含めた複雑な機構によって制御されていることが分かっています。
一方で、科学の研究成果やデータを公開し、再利活用を推進するオープンサイエンスのニーズが近年高まっています。しかし、公開データには品質の低いものも混在しているため、客観的に品質を評価されたデータの公開が重要です。科学雑誌『Scientific Data』のData Descriptor[9]は、科学研究の基盤となる実験・観測データセットを詳細に記述したコンテンツです。データ収集の具体的方法やデータの信頼性を示すことで、データの再利用を促進することを目的としています。
研究手法と成果
研究チームは2022年5月、iPS細胞から肝細胞様細胞への分化の過程を詳細に解析し、転写因子GATA6が肝細胞分化初期にDNA脱メチル化を引き起こすことを示し注)、複数のオミックスデータを取得しました。
本研究では、2022年にヒトiPS細胞から肝細胞様細胞への分化誘導過程で得られた経時的網羅的DNAメチル化データ(メチロームデータ)、遺伝子発現データ、クロマチン状態データ、および転写因子GATA6のDNAへの結合動態のデータを用いました。これらのデータの再利用促進を目的として、各データの品質と信頼性を評価しました(図)。具体的には、次世代シークエンサー[10]により得られたDNA配列データの信頼性を1塩基レベルで示しました。また、メチロームデータをメチル化度分布で、遺伝子発現データの再現性を主成分分析[11]で、クロマチン状態データをオープンクロマチン領域[8]分布解析で、GATA6結合動態を新しい結合モチーフ解析[12]でそれぞれ評価しました。
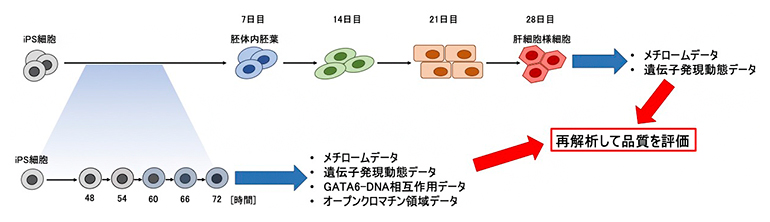
図 ヒトiPS細胞から肝細胞様細胞への分化誘導過程と取得したオミックスデータ
iPS細胞は、段階的なエピジェネティック・トランスクリプトミックな変化を経て肝細胞様細胞へと分化する。
- 注)2022年5月6日プレスリリース「肝細胞発生過程で働く遺伝子スイッチ」
今後の期待
今後、本研究のデータを用いることで、ヒトiPS細胞から肝細胞様細胞への分化機構が明らかになると期待できます。本成果は、体外で効率的に機能性の高い肝細胞や肝臓を作り出すことにつながり、将来的に肝疾患の治療や創薬に貢献すると期待できます。
補足説明
- 1.iPS細胞、多能性幹細胞
動物の初期胚が持つ、体を構成する全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせることで、人工的に作製した多能性幹細胞。iPSはinduced Pluripotent Stemの略。 - 2.オミックス、ゲノム、トランスクリプトーム、エピゲノム
ゲノムとはgene(遺伝子)と総体を表す-omeを組み合わせた言葉で「遺伝子(遺伝情報)の全体・総体」を意味する。同様にトランスクリプトームは「transcript(転写産物)全体」、エピゲノムはepi-(後に)とゲノムを組み合わせて「DNAやヒストンへの後天的な化学修飾により遺伝子の働きを決める情報の総体」を指す。各分子レベルの一定の総体を-omeとしたとき、それらを総合してオミックスという。 - 3.データサイエンス
数学、統計学、機械学習、プログラミングなどあらゆるアルゴリズムを活用し、莫大なデータから科学的に有益な発見を導き出す学問。 - 4.オープンサイエンス
インターネットを通じて、研究者だけでなく誰もが科学情報を利用できるよう、成果やデータを一般に公開・普及する動き。 - 5.胚体内胚葉細胞
発生初期に胚の内部細胞塊から分化してくる細胞で、将来的に肝臓、肺、すい臓、小腸や大腸を構成する細胞へと分化する。 - 6.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域(エンハンサー、プロモーター、サイレンサーなど)に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。 - 7.DNAメチル化
エピジェネティック制御の一種。遺伝子発現制御領域にあるシトシンにメチル基が付加されることにより、下流の遺伝子発現が抑制される。例えばがん細胞では、しばしばがん抑制遺伝子の発現がその発現制御領域の異常なメチル化により抑制されている。 - 8.クロマチン、オープンクロマチン領域
クロマチンはゲノムDNAとヒストンタンパク質から成る複合体。クロマチンの立体構造の変化により、転写因子や遺伝子発現に必要なタンパク質の結合しやすさを物理的に調節することで、遺伝子発現を制御している。クロマチンのうち、立体構造が開いた状態の部分をオープンクロマチン領域という。 - 9.Data Descriptor
科学雑誌『Scientific Data』に掲載される主要なコンテンツ。実験で得られたデータの品質に対する客観的な評価を記述する。従来の研究出版物の補完、あるいはそのデータを他の研究者が再利用できるよう促進することを目的とする。 - 10.次世代シークエンサー
DNAの塩基配列を決定するための装置で、従来の方法と異なる方法でより高速高精度に塩基配列を決定することができる。ヒトゲノム解読を目指して開発された。 - 11.主成分分析
多次元データの持つ情報をできるだけ損なわずに低次元空間に情報を縮約することで、データを理解しやすくする分析手法。 - 12.結合モチーフ解析
転写因子など、DNAに結合するタンパク質は、それぞれ特定の塩基配列を持つDNA領域に結合する。この特定の塩基配列を結合モチーフといい、得られたゲノム情報中に現れる結合モチーフの特徴や、そのモチーフを持つタンパク質は既知かどうかを導き出すことを結合モチーフ解析という。
研究チーム
理化学研究所 生命医科学研究センター 細胞機能変換技術研究チーム
大学院生リサーチ・アソシエイト 田中 優希(タナカ・ユキ)
テクニカルスタッフⅠ 降籏 絵里奈(フルハタ・エリナ)
テクニカルスタッフⅠ 前田 紫緒里(マエダ・シオリ)
テクニカルスタッフⅠ(研究当時)木嶋 真美(キシマ・マミ)
チームリーダー 鈴木 治和(スズキ・ハルカズ)
客員主管研究員 鈴木 貴紘(スズキ・タカヒロ)
(株式会社ウィズ・パートナーズ ディレクター)
研究支援
本研究は、理研生命医科学研究センター応用ゲノム解析技術研究チームの次世代シークエンス解析支援を受けて行われました。
原論文情報
- Yuki Tanaka, Erina Furuhata, Shiori Maeda, Mami Kishima, Harukazu Suzuki, Takahiro Suzuki, "A dataset of definitive endoderm and hepatocyte differentiations from human induced pluripotent stem cells", Scientific Data, 10.1038/s41597-023-02001-9
発表者
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
大学院生リサーチ・アソシエイト 田中 優希(タナカ・ユキ)
客員主管研究員 鈴木 貴紘(スズキ・タカヒロ)
チームリーダー 鈴木 治和(スズキ・ハルカズ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
