2013年7月29日
独立行政法人理化学研究所
慢性閉塞性肺疾患の増悪患者の症状を模倣したマウスを簡便に作製
-慢性閉塞性肺疾患(COPD)増悪のメカニズム解明に有用-
ポイント
- 毒素の一種であるリポ多糖を投与するだけで増悪モデルマウスを作製
- 増悪モデルマウスは強い炎症反応を示し、細胞傷害性Tリンパ球も増加
- COPDの増悪のメカニズム解明や治療薬・予防薬の開発に貢献
要旨
理化学研究所(理研、野依良治理事長)は、ヒト慢性閉塞性肺疾患(COPD)[1]の増悪患者の症状を模倣したマウスを非常に簡便な方法で作製することに成功しました。これは、理研グローバル研究クラスタ(玉尾皓平クラスタ長)理研-マックスプランク連携研究センターシステム糖鎖生物学研究グループ疾患糖鎖研究チームの谷口直之チームリーダー、小林 聡研究員、藤縄玲子テクニカルスタッフら、および群馬大学、慶應義塾大学、日本医科大学との共同研究グループによる成果です。
主に喫煙によって発症するCOPD患者は年々増加しています。COPD患者では、しばしばバクテリアやインフルエンザウイルスなどの感染によって、肺機能および全身の状態が悪化する“増悪”が起こり、増悪を繰り返すことで気腫化などの病状が悪化し、死亡率が高まります。しかし増悪のメカニズムは不明な部分が多いため、まだ効果的な治療薬も開発されていません。
研究グループは、肺気腫を発症させたマウス(気腫モデルマウス)に毒素の一種であるリポ多糖[2]を投与するという簡便な方法で増悪の症状を模倣した「増悪モデルマウス」の作製に成功しました。このマウスでは、気腫モデルマウスよりも強い炎症反応が観察され、免疫細胞のうち細胞傷害性Tリンパ球が劇的に増加していました。また、コンピュータ断層撮影(CT)で気腫を解析した結果、増悪モデルマウスでは気腫モデルマウスに比べ気腫化が進行していることも初めて分かりました。
この増悪モデルマウスはヒトCOPDの増悪患者の症状を模倣しているため、増悪のメカニズム解明や治療薬・予防薬の開発に有用であると考えられます。
本研究成果は、米国の呼吸器雑誌『American Journal of Respiratory Cell and Molecular Biology』オンライン版(7月2日付け:日本時間7月3日)に掲載されました。
背景
主に喫煙によって発症する慢性閉塞性肺疾患(COPD)により世界中で年間300万人以上が死亡しており、今後10年でさらに増加すると予測されています(出典:WHO Fact sheet N°315)。
COPDは不可逆的な気道の閉塞や肺胞壁の破壊、肺の異常な炎症反応を特徴としています。これらの症状は、白血球の一種である好中球、リンパ球などの免疫細胞成分の集積や、タンパク質分解酵素、サイトカインなどの産生異常が原因となり現れます。免疫機能に障害が起こるためため、COPD患者ではバクテリアやウイルス感染による“増悪”がしばしば引き起こされ、増悪を繰り返すことで病状が悪化し、死亡率も高まります。しかし、詳細な増悪のメカニズムはいまだに不明な部分が多いため、メカニズム解明には増悪を模倣するモデル動物が不可欠でした。そこで、研究グループは簡便な増悪モデルマウスの作製を目指しました。
研究手法と成果
タンパク質分解酵素であるエラスターゼをマウスの気管内にスプレーすると、約3週間後にCOPDの主な症状である肺気腫が形成され、「気腫モデルマウス」を作製できます。研究グループは、この気腫モデルマウスに毒素の一種であるリポ多糖を1回投与するという簡便な方法で「増悪モデルマウス」を作製することに成功しました(図1)。また比較として、エラスターゼもリポ多糖も投与していないマウス(コントロール)にリポ多糖だけを投与した「炎症モデルマウス」も作製しました。
炎症モデルマウスでは、リポ多糖投与1日後に肺に炎症細胞が集積していたのに対し、増悪モデルマウスではリポ多糖投与3日後にほかのマウス群よりも強い集積のピークを示しました。また、炎症モデルマウスと増悪モデルマウスで肺に集積した炎症細胞を詳しく調べたところ、増悪モデルマウスでは細胞を傷害する能力をもったCD8[3]陽性のTリンパ球[4]が劇的に増加していました(図2)。さらに、COPDの増悪に関係するといわれているマトリックスメタロプロテアーゼ-9(MMP-9)[5]の活性が増加していることも分かりました。
次に、CTで気腫の様子を長期観察しました。その結果、増悪モデルマウスでは気腫モデルマウスに比べ気腫化が進行していたことも初めて分かりました。また、その気腫部分を3Dイメージで再構築することで、視覚的にも増悪の進行具合を比較することができました(図3)。
今後の期待
今回、作製した増悪モデルマウスはヒトCOPDの増悪患者の症状を模倣しているため、増悪のメカニズム解明や治療薬•予防薬の開発に有用であると考えられます。
原論文情報
- Satoshi Kobayashi Reiko Fujinawa, Fumi Ota, Shiho Kobayashi, Takashi Angata, Manabu Ueno, Toshitaka Maeno, Shinobu Kitazume, Keiichi Yoshida, Takeo Ishii, Congxiao Gao, Kazuaki Ohtsubo, Yoshiki Yamaguchi, Tomoko Betsuyaku, Kozui Kida, and Naoyuki Taniguchi..
"A Single Dose of LPS into Mice with Emphysema Mimics Human COPD Exacerbation as Assessed by Micro-CT" American Journal of Respiratory Cell and Molecular Biology,doi: doi/abs/10.1165/rcmb.2013-0074OC
発表者
理化学研究所
グローバル研究クラスタ 理研-マックスプランク連携研究センター システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
チームリーダー 谷口 直之(たにぐち なおゆき)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.慢性閉塞性肺疾患(COPD)
喫煙などにより、肺でガス交換を行う肺胞の壁が破壊される肺気腫と、空気の通り道である気管や両肺の分岐部分の気管支で引き起こされる炎症などを含む慢性的な呼吸器疾患の一種。初期は無症状だが、進行すると息切れや痰が増えてくる。COPDになると肺炎などの感染症を起こしやすく、重症化しやすい。 - 2.リポ多糖
大腸菌などのグラム陰性細菌の細胞壁外膜に存在し、脂質や多糖からなる毒素の一種。生体に作用するとさまざまな毒性を発揮する。 - 3.CD8
細胞傷害性Tリンパ球の表面にある糖タンパク質。この分子を持つTリンパ球は異物だと認識した細胞(感染やがん化した細胞など)を破壊する。 - 4.Tリンパ球
リンパ球の一種で、血液中のリンパ球の70~80%を占める。通常CD4あるいはCD8どちらかの分子を細胞表面に持ち、炎症反応に大きく関わる。 - 5.マトリックスメタロプロテアーゼ(MMP-9)
細胞の表面や外側の構成成分であるコラーゲンなどのタンパク質を分解する酵素。COPDにおいては活性が上がるといわれている。

図1 増悪モデルマウスの作製手順
マウスの気管内にタンパク質分解酵素であるエラスターゼをスプレーすると、約3週間後に肺気腫が形成され気腫モデルマウスができる。この気腫モデルマウスに毒素の一種であるリポ多糖を1回投与したマウスが増悪モデルマウスである。
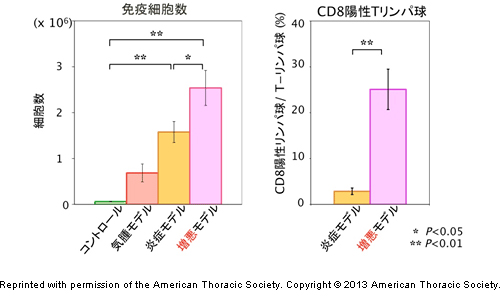
図2 リポ多糖投与3日後に肺へ集積した細胞の解析結果
増悪モデルマウスではリポ多糖を投与してから3日後に肺へ集積する炎症細胞が、ほかに比べて最も多く(左)、中でもCD8陽性Tリンパ球の数は炎症モデルマウスに比べ増加していた(右)。
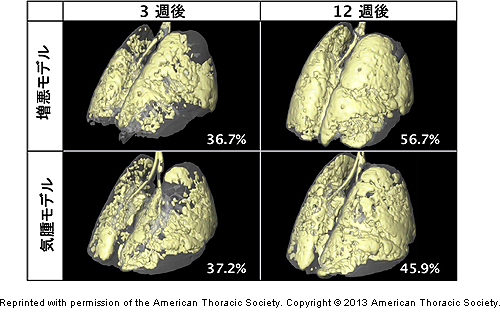
図3 エラスターゼ投与3週間後、12週間後の気腫モデルマウスと増悪モデルマウスの肺
黄色が気腫化部分、数値は気腫の程度を示す。CT解析により、増悪モデルマウスでは気腫化の進行が確認できた。
