ポイント
- 血液内から分離した非リンパ球の白血球をドナー細胞に応用
- 細胞の大きさにより、ドナー細胞用の白血球を85%の高効率で選択
- 不妊マウスや系統最後のマウスの系統を維持する技術の確立
要旨
理化学研究所(理研、野依良治理事長)は、たった1滴の血液から分離した非リンパ球の白血球[1]を用いて、体細胞クローンマウスを作出することに成功しました。これは、理研バイオリソースセンター(小幡裕一センター長)遺伝工学基盤技術室の小倉淳郎室長(筑波大学大学院生命環境科学研究科教授兼任)、上村悟氏大学院生リサーチ・アソシエイトと、生体情報統合技術開発チームの三好浩之開発研究員、および統合生命医科学研究センター統合ゲノミクス研究グループの小原收グループディレクター(かずさDNA研究所副所長兼任)を中心とする共同研究グループによる研究成果です。
体細胞核移植クローン技術[2]は、核を除いた卵子(除核卵子)に体細胞(ドナー細胞)を移植することで、ドナー細胞と同じ遺伝情報を持つ個体を作出することができる技術です。体細胞核移植に用いるドナー細胞は、マウスに負担をかけず、迅速にわずかな組織から採取できることが望まれています。しかし、従来法ではドナー細胞を臓器から外科的手術によって採取するために、個体を犠牲にせざるをえませんでした。そこで、共同研究グループは、ドナー動物に採取負担の少ない血液に着目し、クローン技術の開発を検討しました。
共同研究グループは、マウスの尾部から採取した1滴の血液内にある非リンパ球の白血球を分離、これをドナー細胞として体細胞クローンマウスを作出することに成功しました。尾部から血液を採取するため、従来法では困難だった生きたまま、かつマウスに負担をかけさせることなくドナー細胞を得ることができます。
白血球には非リンパ球のものとリンパ球のものがあり、リンパ球のDNAは再構成されているためクローン技術には適していません。ドナー細胞には非リンパ球の細胞だけを利用する必要があります。そこで判別法を検討したところ、直径8μm(マイクロメートル)以上の細胞を顕微鏡下で選ぶことで、約85%の正確さで非リンパ球が得られることが分かりました。
体細胞核移植クローン技術はさまざまな分野での応用が期待されています。今回の成果により、特にマウスを用いる医学生物学の分野では、不妊マウスや系統最後のマウスから系統を復活し、維持できる可能性を高められると期待できます。
本研究成果は、米国の科学雑誌『Biology of Reproduction』オンライン版(6月26日付け:日本時間6月27日)に掲載されます。
背景
体細胞核移植クローン技術は、同じ遺伝情報を持ったコピーを無限に生産できることから、畜産分野、創薬、絶滅の危機にある種の保存などに応用が期待されています。マウスでは、これまでに10種類以上のドナー細胞からクローンを作出できることが報告されてきました。しかし、従来法ではドナー細胞を臓器から採取するために、ドナー細胞提供動物に手術などを行い採取しなければならない場合が多く、個体を犠牲にせざるをえませんでした。また比較的容易に採取できるとされる皮膚の細胞(線維芽細胞)を用いる場合でも、クローンに適した細胞を得るのに約2週間という長い細胞培養時間が必要でした。そのため、体細胞核移植に用いるドナー細胞は、ドナー動物に負担をかけず、迅速にわずかな量だけ採取できることが望まれています。
共同研究グループは、わずかな量でありながらクローンを行うために十分な量の細胞を採取できる可能性があることから、さまざまな細胞の中から血管中の血液に存在する白血球をドナー細胞として用いることに着目しました。そして、マウスに負担への少ない尾部から微量の血液を採取し、その血液から得た白血球を用いて、体細胞クローンマウスの作出を試みました。
研究手法と成果
共同研究グループは、1滴(15~45μℓ)の血液から分離し、ランダムに選んだ白血球をドナー細胞として用いたところ、体細胞クローンマウスの作出に成功しました(図1)。しかし、白血球には、リンパ球の白血球(T細胞とB細胞)と非リンパ球の白血球(骨髄系細胞の顆粒球や単球)が含まれています。リンパ球は、再構成されたDNAを持つため、これをドナー細胞とした体細胞クローンマウスは、全身のDNAが再構成されて生まれてしまい、元のマウスとは遺伝的に異なってしまいます。このため、実際の体細胞クローンマウスの作出には非リンパ球を選ぶ必要があります。
通常、特定の細胞を生きたまま分離するためには、FACS[3]という手法を用いますが、そのためには十分な量の細胞が必要になります。今回は、微量の血液であるために適用できません。そこで、非リンパ球の白血球を選ぶために、細胞の大きさを利用できるかどうか調べたところ、直径8μm以上の細胞を顕微鏡下で選ぶことで、約85%の正確さで非リンパ球を選べることが分かりました(図2)。この方法を用いて、5系統のマウスの非リンパ球の白血球から体細胞クローンマウスを得ることに成功しました。
従来法の卵丘細胞[4]をドナー細胞として使用すると、クローン胚数あたり2.7%の効率で産仔が得られました。非リンパ球の白血球をドナー細胞として使用すると2.1%の効率であったことから、今回新しく開発した方法は従来法と同様の産仔獲得効率を示しました。さらに、雌の体細胞クローンマウス(図3)は、生後8週齢で雄と交配したところ正常な繁殖能力を示し、また野生型と変わらない寿命であることも分かりました。
今後の期待
体細胞クローン技術は、畜産分野をはじめ、創薬や医学分野などへの幅広い応用が期待されています。今回の研究で生きたマウスの血液1滴を用いて、遺伝的なコピーが作出できることが明らかとなりました。これによって、特にバイオリソース分野では、不妊マウスや系統最後のマウスの系統を維持できる可能性を高められると期待できます。
原論文情報
- Kamimura et al. "Mouse Cloning Using a Drop of Peripheral Blood". Biology of Reproduction, 2013, doi: 10.1095/biolreprod.113.110098
発表者
理化学研究所
バイオリソースセンター 遺伝工学基盤技術室
室長 小倉 淳郎 (おぐら あつお)
お問い合わせ先
バイオリソース推進室
Tel: 029-836-9142 / Fax: 029-836-9100
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.白血球
生体防御に関わる免疫機能を司る細胞群。通常、血液内に存在する白血球は、顆粒球・単球・リンパ球(T細胞およびB細胞)とされる。さらに免疫機能的特性によって、非リンパ球(顆粒球・単球)とリンパ球に分けられる。 - 2.体細胞核移植クローン技術
染色体を除いた未受精卵子へ体細胞核を移植し、胚を作出する技術。体細胞ゲノムは、卵子細胞質内へ移植されると、再プログラム化(初期化)され、受精卵とほぼ同じ状態になることが知られているが、そのメカニズムはまだ不明。山中伸弥博士とともに2012年ノーベル生理学・医学賞を受賞したジョン・ガードン博士が、1960年代にカエルを用いて初めて成功した。哺乳類では、ヒツジ、マウス、ウシなど多くの動物種で産子が得られている。 - 3.FACS
細胞などの特性を、蛍光染色して1個ずつ、迅速かつ高感度に測定する方法。細胞内外の蛍光強度、細胞の大きさ、内部構造といった生物学的特性を測定でき、さらにそれらの情報に基づき特定の細胞だけを、生きたまま、高速で分取することも可能。 - 4.卵丘細胞
卵子の周りを取り囲むように存在する細胞。1998年に若山照彦博士と柳町隆造博士が世界で初めて体細胞クローンマウスを作出した際に使用されたドナー細胞として知られる。
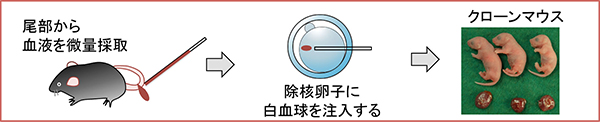
図1 微量血液から採取した白血球からの体細胞クローンマウスの作出方法
個体に負担をかけさせないよう尾部から血液を微量採取する。微量血液中に存在する白血球を除核卵子に注入し、雌マウスの卵管に移植することによって、体細胞クローンマウスを作出する。
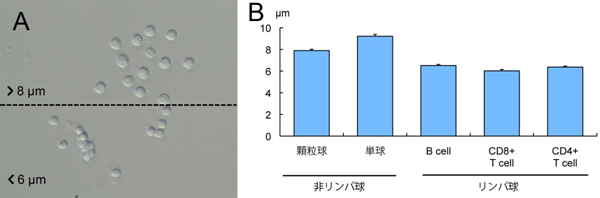
図2 目視のサイズ選別による白血球像(A)
白血球にFACSを行った後の細胞種ごとのサイズ計測(B)
- (A) 白血球の大きさを顕微鏡下、目視で選別した。大きい細胞は8μm以上だった。
- (B) FACSによって白血球を細胞種ごとに分け、顕微鏡下で細胞のサイズを計測した。その結果、非リンパ球はリンパ球よりも大きいことが分かり、8μm以上の細胞を選択することで体細胞クローンに適した非リンパ球を選択できることが分かった。

図3 非リンパ球から作出した雌の体細胞クローンマウス
非リンパ球から作出した雌の体細胞クローンマウスは、生後8週齢で雄と交配したところ正常な繁殖能力を示し、また野生型と変わらない寿命だった。
